CHEMISTRY AROUND THE WORLD When we see something around us, we recognize that every single thing is chemistry. So certainly, for better live, we have to motivate ourselves to learn everything around us. "Green Education through Eco Chemistry."
WELCOME TO MOB +
Please motivate yourselves to follow my web.
Enjoy improving your skill and ability in science teaching/ learning, especially in chemistry.
I ask you also to leave a comment in my articles.
Thanks a lot.
Green Education through Eco Chemistry
"Green Education" bertujuan untuk melancarkan peningkatan kualitas pendidikan bangsa melalui penerapan "Eco Chemistry", yaitu pembelajaran yang dilakukan dengan memanfaatkan segala sesuatu yang alami, ramah lingkungan, sehat, praktis dan ekonomis. Pembelajaran ini memerlukan motivasi diri, internal maupun eksternal dan kepedulian terhadap lingkungan hidup.
Ide ini muncul sejak dicanangkannya tahun 2011 sebagai Tahun Internasional Kimia yang bertepatan dengan peringatan 100 tahun Marie Curie menerima hadiah nobel sebagai ilmuwan kimia wanita pertama. Sedang pemikiran dasar terungkapnya ide ini disebabkan oleh masalah dunia yang sangat memerlukan perhatian, yaitu "Green House Effect" dan "Global Warming." Tindakan ini merupakan salah satu wujud partisipasi aktif penulis terhadap pelaksanaan program wajib belajar 12 tahun dan "Surabaya Eco School."
Penulis mengajak pembaca untuk menerapkan "Green Education" melalui "Eco Chemistry" dalam kehidupan sehari-hari. "Green Education" berlangsung seumur hidup (Long life Education), sejak janin dalam kandungan ibu hingga akan masuk ke liang kubur. Marilah dengan niat dan tekad yang kuat kita tingkatkan terus pendidikan diantara kita, terutama anak bangsa sebagai generasi penerus. Pendidikan ini dapat berlangsung Dimana saja dan Kapan saja.
Contoh penerapan "Eco Chemistry" dalam pembelajaran di SMA Negeri 16 Surabaya secara bertahap penulis terbitkan dalam bentuk artikel. Pembelajaran "Eco Chemistry" yang dimulai di sekolah, terus dilanjutkan secara bertahap ke masyarakat. Diharapkan melalui terobosan baru ini, yaitu penerapan "Eco Chemistry", masyarakat memahami dan menyadari bahwa kimia sangat berperan dalam kehidupan dan masa depan bangsa. Hal ini sesuai dengan slogan "International Year of Chemistry 2011" (IYC 2011), yaitu Chemistry: Our Life and Our Future" yang telah ditetapkan oleh PBB melalui UNESCO. Insya Allah tujuan pendidikan ini dapat tercapai secara optimal.
Web Blog Sejuta Guru Indonesia
Ini adalah Blog lamaku yang hingga saat ini digunakan oleh banyak guru, siswa, dan pihak lain yang memerlukan.
Saya juga memiliki Blog Baru lagi yang isinya mulai banyak dan artikel-artikelnya banyak yang berasal dari pertanyaan pengunjung dan permintaan artikel khusus.
Saya akan berupaya untuk mempublish artikel-artikel baru di kedua Blog ini, termasuk blog-blog saya yang lain. Insya Allah tiap hari saya tetap dapat meluangkan waktu untuk menulis artikel, baik tentang kimia, pendidikan seumur hidup, Eco School, kesehatan, dan artikel lainnya.
Semoga kebiasaan menulis ini tak pudar oleh apapun, walau memasuki usia senja. Berbuat yang terbaik untuk anak bangsa begitu indah, marilah bersama cerdaskan bangsa.
Terima kasih
Silakan Berkunjung di http://etnarufiati.guru-indonesia.net
Wednesday, 2 December 2009
PENJELASAN SKL-6 KIMIA SMA/MA 2010 Bagian I
My Blog List
-
Sejauh mana bahaya pewarna pada makanan? - Bagaimana kita bisa hidup lebih baik, jika kita kurang berhati-hati terhadap makanan. Sehat adalah salah satu faktor utama untuk hidup lebih baik. Jika mak...14 years ago
-
KWACI BIJI BUNGA MATAHARI - Eh perhatikan gambar berikut, kenalkah Anda? Pernah membeli dan memakannya? Ini adalah kwaci biji bungan matahari. Anda suka kwaci? Kwaci yang mana? Kecil ...14 years ago
-
PETROLEUM PROBLEMS - 1. Natural gas is a mixture of lightweight alkanes. A typical sample of natural gas when it is collected at its source contains methane, ethane, propane, b...16 years ago
-
^()^ Empire of The Apes 2013 Streaming Online HD - Where Can I Stream Empire of The Apes In Good Quality Empire of The Apes Summary: In a distant galaxy three escaped female convicts crash land on a primi...5 years ago
-
KOLOID DI SEKITAR KITA Bagian III - Apakah Anda sudah mencatat semua koloid yang terdapat di lingkungan hidup kita? Dari pengamatan pendahuluan yang telah Anda lakukan terhadap koloid, yaitu ...15 years ago
-
-
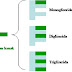
GLISERIDA - Gliserida adalah ester gliserol, yaitu ester alkohol trivalen. Gliserida terdiri atas gliserol dan asam lemak suku tinggi. Asam lemak ini memiliki rantai...14 years ago

No comments:
Post a Comment